11장이 참조해야할 그림도 많고 내용도 만만치 않아서 13장먼저 정리하고 돌아왔습니다.ㅎㅎㅎ
11장부터 12장 그 이후까지 연결되는 내용이기 때문에 착실하게 정리해봅시다.!
개념들
1.성분(component) : 성분이란 합금을 구성하는 순금속이나 화합물을 의미합니다. 예를 들면, 황동의 성분은 구리(Cu)와 아연(Zn).
2.용해한도(Solubility limit) : 고용체 형성에 있어 용매에 용해되는 용질 원자의 최대 농도는 온도에 따라 정해져있는데, 이를 가르켜 용해한도라고 합니다. 용해 한도 이상으로 용질을 첨가하게 되면 별개의 고용체나 화합물이 생성됩니다. 설탕물을 떠올려봅시다. 상온의 물에 설탕을 넣어 섞게되면 설탕이 잘 녹게되겠죠. ㅎㅎ그러나 넣은 설탕의 양이 용해 한도 이상으로 되면 설탕은 더이상 녹지 않고 바닥에 가라앉게 됩니다. 즉, 물이 수용할 수 있는 설탕의 양이 초과된 것입니다. 용해도를 높이는 방법에는 설탕물을 젓는 것과 설탕물의 온도를 높이는 방법이 있겠습니다.
3.상(Phase) : 상태도를 이해하는 데 가장 중요한 개념으로, 상은 물리적, 화학적 특성이 균일한 계의 균질한 부분이라 정의합니다. 조성(component)과 결정구조가 같을 때를 일컬음. 예를 들어, 설탕물(액체)은 하나의 상이며, 각설탕(고체)도 하나의 상이지만, 각각의 결정구조는 다르기 때문에 서로 다른 상이 됩니다.
1개의 상으로 구성된 계를 균질계(homogeneous system)라 하고, 2개 이상의 상으로 구성된 계를 비균질계(non-homogeneous system) 또는 혼합물(mixture)이라 부릅니다.
대부분의 금속 합금과 세라믹, 폴리머는 비균질계겠죠?
4.상평형(Phase equilibrium) : 상평형이란 1개 이상의 상이 존재하는 계의 평형을 의미하며, 시간에 따라 상이 변하지 않는다는 것을 의미합니다.
단일 성분(1원) 상태도

상(phase)에 영향을 주는 인자는 온도(T), 압력(P), 그리고 조성이 있고, 매개변수 사이의 관계를 나타낸 것이 바로 상태도(phase diagram)입니다. 가장 간단한 상태도는 조성은 일정하고, 온도와 압력만이 변수인 1원 상태도입니다. 위 그림은 물의 상태도입니다.
각각의 선을 기준으로 세 가지 상(고체, 액체, 기체)이 구분되어있습니다. 상 경계는 용해한도(Solubility limit)를 의미하며, 이 선에서는 접해있는 물질 사이의 자유에너지가 같아서 그 결과 driving force(구동력)가 존재하지 않으므로 두 상이 공존하는 지점입니다. 세 개의 선도가 만나는 점을 삼중점 혹은 삼상점(Triple point), 또는 이 위치에서는 점이 특정 온도와 압력으로 고정되기 때문에 불변점(Invariant point)이라 부르기도 합니다. 기체와 액체를 나누는 경계선 c를 자세히 살펴보시면, 끝까지 이어지지 않아 있음을 알 수 있습니다. 기체상태인 물 분자의 압력이 점점 높아지면서 물 분자간의 거리가 계속 좁아지게 되다가, 언젠가 액체 상태의 물분자 거리만큼 가까워지게 됩니다. 따라서 분자들 사이의 인력이 매우 강해지면서 마치 액체인 것처럼 거동하게 되고, 이를 Superfluid라 부릅니다. 즉, 이 상태에서는 기체와 액체가 구분되지 않기 때문에 상 경계로 나누지 못하는 것입니다.
2원 상태도 (Binary system)
2원 상태도부터는 합금이 2개의 성분으로 구성되어 있습니다.(구리와 니켈, 철과 탄소처럼 말이죠_) 대부분의 합금은 2가지 이상의 성분으로 구성되어 있지만, 기본 원리는 2원 상태도에서부터 파생되기 때문에 2원 상태도를 이해하는게 가장 중요하겠습니다. 2원 상태도는 온도와 조성을 조절해가면서 합금의 상변태(Phase transformation)를 나타내는 지도라 할 수 있습니다.

위 그림은 구리-니켈 계 (Cu-Ni)계를 간단하게 나타낸 것입니다. 세로축은 온도(T)를, 가로축은 니켈의 무게 함량(Ni wt%)을 나타냅니다. 따라서 가로축의 오른쪽으로 갈수록 니켈의 함량이 높아지며, 원점에 가까울수록 구리의 함량이 높아지게 되겠죠. 액상 L은 구리와 니켈로 이뤄진 균질한 액체 용액이고, α상은 FCC 결정구조를 가진 치환형 고용체입니다. 사이의 B지점은 α+L상으로 액상과 고상이 같이 존재하게 됩니다.

상태도의 어느 한 지점에서 상의 조성을 구하는 방법은 매우 간단합니다.
1. 단일상의 영역에 존재한다면, 그 점에서부터 수선을 내려 상태도의 니켈 함유랑을 읽어주면 되겠죠.
2. 위 그림의 점 B처럼 α+L상에 있을 경우는 조금 다른 방식을 사용해 줍시다. 우리가 구하려 하는 것은 B점에서의 L과 α의 조성입니다.
우선 가로축에 평행한 선을 상 경계와 만날때까지 그어줍니다. 그 후, 각 교차점에 해당하는 조성(C_L, Cα)을 표시합니다.점 B는 α+L상에 있으므로 각각의 상을 구해줘야 됩니다.
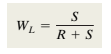

이 방식을 통해 B에 존재하는 액상L과 고상 α의 무게 분율을 구할 수 있습니다. 이를 지렛대의 원리(lever rule)라 합니다. 자신에서부터 먼 쪽이 분자라고 기억합시다. 예를 들어, 액상의 무게분율 식을 보겠습니다. S는 상대적으로 R보다 액상으로부터 멀리 떨어져있습니다. 따라서 위의 식과 같이 Wl=S/(R+S)가 됩니다. 이를 조성의 식으로 표현해주면 (Cα-C0)/(Cα-Cl)이 됩니다.

다음은 일정한 조성축에서의 상변화를 알아봅시다. 상태도는 구리-니켈 합금계이며, 조성은 35 Ni wt% 지점으로 가정합시다.
먼저 점 a는 액상 L에만 존재하므로 오로지 액상으로만 구성되어 있습니다. 이후 온도가 점점 내려가다가 α+L의 상 경계와 만나는 시점부터 α상이 생기기 시작합니다. 위에서 배운 내용으로 액상과 고상의 무게분율을 구해주면 위와 같이 나타납니다.(직접 구하지는 않겠습니다. 온도가 더욱 내려갈수록 고상이 점점 증가하는 모습을 볼 수 있습니다. b, c, d로 갈수록 α상의 무게분율은 46, 43, 35로 감소하게 됩니다. 마침내 온도가 계속 낮아져 α상경계와 만난 후, 점 e로 내려오게 되면, 액상은 완전히 사라지고, 35 Ni wt%로 이뤄진 고상 α만 남게 됩니다.
문제로 출제될 수 있는 사안으로는 상태도를 주고 조성을 구하는 문제. 그리고 지렛대 원리를 유도하는 문제가 있을 수 있겠죠.
더 나아간다면 우리는 성분비를 구할 수 있기 때문에 밀도를 알게 된다면(밀도를 준다면) 그걸 활용해서 무게비율에서 부피 비율로 전환시키는 문제도 출제 될 수 있겠습니다. ㅎㅎ
다음시간에는 더 자세한 사안(조성에 따라 나타나는 미세구조 차이 등)들에 대해 알아보겠습니다. 감사합니다.
재료과학과 공학 9판을 참고하였습니다.
Materials science and engineering an introduction (William D Callister, Jr. David G Rethwisch)
'재료과학과 공학 > 11장 상태도' 카테고리의 다른 글
| [재료과학과 공학] 11장 상태도 (2)미세조직 /납-주석 합금/공정, 공석, 포정, 포석 (0) | 2022.07.30 |
|---|---|
| [재료과학과 공학] 11장 상태도 (0)탄소강(페라이트, 펄라이트, 오스테나이트, 시멘타이트) (0) | 2022.07.28 |


댓글